Какое твп при синдроме дауна
Какое твп при синдроме дауна
Какое твп при синдроме дауна
Два из опубликованных в последнее время обширных исследования вызвали большой интерес к использованию этого эхографического маркера в качестве средства для скринингового обследования пациенток из общей популяции. P. Taipale et al. выполнили трансвагинальную эхографию у 10 010 беременных подросткового возраста и женщин моложе 40 лет с одноплодной беременностью в сроки от 10 до 15,9 нед гестации. Толщина воротникового пространства 3 мм и более или кистозная гигрома шеи (с внутренними перегородками) была обнаружена у 76 (0,8%) плодов, 18 (24%) из которых имели аномалии кариотипа.
Чувствительность диагностики трисомии (21, 18 и 13) была равна 62% (13 из 21), а чувствительность изолированно для трисомии 21 составила 54% (7 из 13).
R.J.M. Snijders et al., используя сочетание двух диагностических критериев: возраст матери и оценку воротникового пространства в сроки от 10 до 14 нед, провели мультицентровое исследование, которое включило в себя результаты обследования 96 127 женщин (с участием 306 специально подготовленных специалистов ультразвуковой диагностики из 22 перинатальных центров). Расчет риска трисомии 21 производили с учетом возраста матери и частоты встречаемости для данного гестационного срока путем умножения на коэффициент вероятности, который зависит от вариабельности значений нормальных показателей толщины воротникового пространства при различных величинах КТР.
Было исследовано распределение риска в представленной популяции и установлено пограничное значение с чувствительностью на уровне 1 : 300. Предполагаемый риск трисомии 21 с учетом возраста матери и размеров воротникового пространства на уровне 1 : 300 и выше был выявлен для 7907 (8,3%) из 95 476 здоровых беременных; у 268 (82,2%) из 326, имевших плодов с трисомией 21, и у 253 (77,9%) из 325 с другими хромосомными нарушениями. Частота ложноположительных результатов составила 8,3%. Было установлено, что 5% из обследованной популяции, имевшие наиболее высокий предполагаемый риск, включили в себя 77% впоследствии обнаруженных случаев трисомии 21.
На основании проведенного анализа авторы заключили, что при помощи эхографического скрининга выделение группы беременных высокого риска для проведения инвазивных вмешательств способствует диагностике 80% патологических беременностей, при этом для выявления одного плода с аномальным кариотипом приходится проводить около 30 инвазивных процедур. Результаты этого исследования были противопоставлены авторами тому факту, что в отсутствии подобного эхографического скрининга могли бы родиться живыми 266 детей с синдромом Дауна. Однако нужно отметить, что данная оценка была проведена без учета хорошо установленной особенности, что до 40% плодов с этим синдромом погибают внутриутробно в сроки от 10 до 14 нед гестации.
Поэтому оценка с учетом истинной частоты встречаемости синдрома Дауна в популяции, которая должна была бы составить соответственно 443 случая, привела бы к снижению точности диагностики до 60% (266 из 443). При использовании такой уточненной методики расчета диагностической точности предложенных критериев для выявления трисомии 21, ее уровень не имеет достоверных различий при сравнении с частотой выявления с помощью используемых в настоящее время диагностических критериев, основанных на оценке биохимических маркеров во втором триместре беременности. Однако несомненно полезным результатом такого скрининга в отношении трисомии 21 является то, что появилась возможность ранней диагностики трисомии 18.
По данным мультицентрового обселедования 91 091 беременных, С. Sherod et al. описали 106 плодов с трисомией 18, 83% из которых были установлены благодаря эхографическому скринингу с использованием оценки воротникового пространства у плода.
– Вернуться в оглавление раздела “Акушерство.”
Какое твп при синдроме дауна
Самые часто встречающиеся ультразвуковые маркеры хромосомной аномалии:
1. Увеличение ТВП.
Оценка этого параметра проводится в первое скрининговое УЗИ (11-14 недель)
ТВП (толщина воротникового пространства) может оказаться больше нормы по нескольким причинам.
Почему у плода может выявляться увеличение ТВП?
Родители бывают крайне взволнованы и хотят сразу же получить ответы на все, возникающие у них вопросы – с чем связано, что делать и многие другие. Вопросы, на которые невозможно ответить сразу. Ведь причин увеличения ТВП множество. Данная находка может встречаться у абсолютно здоровых плодов, это не порок развития, это лишь сигнал к более глубокому обследованию, потому что такая особенность может иметь место у плодов с хромосомной патологией, аномалиями сердца либо другими врожденными или наследственными заболеваниями. При увеличении максимального порога ТВП ВАЖНО, чтобы врач оценил все остальные ультразвуковые маркеры (признаки), а также провел детальную оценку анатомии плода. Возможно, причина увеличения ТВП кроется в нарушении развития плода (например, аномалии строения сердца).
Что делать при выявлении увеличения ТВП у плода?
Если у вашего плода обнаружили расширение ТВП, Вас обязательно направят на консультацию к врачу генетику, который собрав анамнез, оценив все риски, даст рекомендации по дополнительным методам исследования (инвазивная диагностика). Далее потребуется экспертное УЗИ плода на сроке 20 недель для детальной оценки анатомии. Если по всем этим исследованиям отклонений не выявлено, то шансы родить здорового ребенка велики даже при значительной величине ТВП.
2. Гипоплазияаплазия костей носа.
Гипоплазия костей носа – уменьшение размеров косточки носа в зависимости от КТР вашего малыша.
Аплазия костей носа – отсутствие визуализации косточки носа у вашего малыша.
Отсутствие видимости костной части спинки носа у плода или ее недоразвитие (недостаточно яркая) на первом скрининге связана с задержкой отложения кальция. Такая ситуация несколько чаще может встречаться у плодов с синдромом Дауна, однако важно, что:
- само по себе отсутствие костей носа на УЗИ не является аномалией развития; может встречаться у абсолютно здоровых плодов (в 3% случаев);
- для оценки степени индивидуального риска необходима оценка остальных ультразвуковых маркеров (толщина воротникового пространства плода, показатели кровотока на сердечном клапане, показатели кровотока в венозном протоке, ЧСС плода) и биохимического анализа материнской сыворотки (РАРР-А, ХГЧ);
- Если результат комбинированного скрининга (оценка в специальной программе данных УЗИ и анализа крови) показывает НИЗКИЙ риск хромосомной патологии – беспокоиться не стоит. Обязательно пройдите контрольное УЗИ в 19-20 недель беременности, где будет проведена тщательная оценка анатомии плода и исследованы определенные ультразвуковые маркеры второго триместра беременности.
- Что делать если результат комбинированного скрининга оказался ВЫСОКИМ? – Переживать не стоит. Вас обязательно направят на консультацию к врачу генетику, который собрав анамнез, оценив все риски, даст рекомендации по дополнительным методам исследования (инвазивная диагностика).
3. Гиперэхогенный кишечник.
Это термин, говорящий о повышенной эхогенности (яркости) кишечника на ультразвуковом изображении. Выявление гиперэхогенного кишечника НЕ является пороком развития кишечника, а просто отражает характер его ультразвукового изображения. Необходимо помнить, что эхогенность нормального кишечника выше, чем эхогенность соседних с ним органов (печени, почек, легких), но такой кишечник не считается гиперэхогенным. Гиперэхогенным называется только такой кишечник, эхогенность которого сравнима с эхогенностью костей плода.
Почему кишечник у плода может быть гиперэхогенным?
Иногда гиперэхогенный кишечник выявляется у абсолютно нормальных плодов, и при УЗИ в динамике этот признак может исчезать. Повышенная эхогенность кишечника может быть проявлением хромосомных болезней плода, в частности, синдрома Дауна. В связи с этим при обнаружении гиперэхогенного кишечника проводится тщательная оценка анатомии плода. Однако при выявлении гиперэхогенного кишечника можно говорить лишь о повышенном риске синдрома Дауна, так как подобные изменения могут встречаться и у совершенно здоровых плодов. Иногда гиперэхогенный кишечник может быть признаком внутриутробной инфекции плода. Гиперэхогенный кишечник часто обнаруживается у плодов с задержкой внутриутробного развития. Однако при этом будут обязательно выявляться отставание размеров плода от срока беременности, маловодие и нарушение кровотока в сосудах плода и матки. Если ничего из вышеперечисленного не выявлено, то диагноз задержки развития плода исключен.
Что делать при выявлении гиперэхогенного кишечника у плода?
Вам следует обратиться к специалисту генетику, который еще раз оценит результаты биохимического скрининга и даст необходимые рекомендации по дальнейшему ведению беременности.
4. Гиперэхогенный фокус в желудочке сердца.
Это термин, говорящий о повышенной эхогенности (яркости) небольшого участка сердечной мышцы на ультразвуковом изображении. Выявление гиперэхогенного фокуса в сердце НЕ является пороком развития сердца, а просто отражает характер его ультразвукового изображения. Гиперэхогенный фокус возникает в месте повышенного отложения солей кальция на одной из мышц сердца, что не мешает нормальной работе сердца плода и не требует никакого лечения.
Почему у плода может выявляться гиперэхогенный фокус в сердце?
Иногда гиперэхогенный фокус в сердце выявляется у абсолютно нормальных плодов, и при УЗИ в динамике этот признак может исчезать. Наличие гиперэхогенного фокуса в сердце плода может быть проявлением хромосомных болезней плода, в частности, синдрома Дауна. В связи с этим при обнаружении гиперэхогенного фокуса проводится тщательная оценка анатомии плода. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только гиперэхогенного фокуса в сердце не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур.
Что делать при выявлении гиперэхогенного фокуса в сердце плода?
Если у плода выявлен ТОЛЬКО гиперэхогенный фокус в сердце, то никаких дополнительных обследований не требуется; риск болезни Дауна не увеличивается. На плановом УЗИ в 32-34 недели еще раз будет осмотрено сердце плода. В большинстве случаев гиперэхогенный фокус в сердце исчезает к этому сроку беременности, но даже если он продолжает оставаться в сердце, это никак не влияет на здоровье плода и тактику ведения беременности.
5. Единственная артерия пуповины.
Нормальная пуповина состоит из трех сосудов – две артерии и одна вена. Иногда вместо двух артерий в пуповине формируется только одна артерия и одна вена, таким образом, в пуповине определяется всего два сосуда. Данное состояние считается пороком развития пуповины, однако этот порок не оказывает никакого влияния на послеродовое состояние ребенка и его дальнейшее развитие.
Почему у плода может определяться единственная артерия пуповины?
Иногда единственная артерия пуповины выявляется у абсолютно нормальных плодов; после рождения ребенка данный факт не оказывает никакого влияния на его дальнейшее развитие. Иногда единственная артерия пуповины сочетается с пороками сердечно-сосудистой системы плода, поэтому при выявлении единственной артерии пуповины проводится детальный осмотр анатомии плода и, в частности, сердечно-сосудистой системы. При отсутствии других пороков развития единственная артерия пуповины в состоянии обеспечить адекватный кровоток плода. Несколько чаще единственная артерия пуповины выявляется у плодов с синдромом Дауна и другими хромосомными болезнями. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только единственной артерии пуповины не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур. Единственная артерия пуповины иногда приводит к возникновению задержки внутриутробного развития плода. В связи с этим при обнаружении единственной артерии пуповины рекомендуется дополнительное УЗИ в 26-28 недель беременности, и плановое в 32-34 недели. Если отставание размеров плода от срока беременности или нарушение кровотока в сосудах плода и матки не выявлено, то диагноз задержки развития плода исключен.
Что делать при выявлении единственной артерии пуповины у плода?
Выявление только единственной артерии пуповины не повышает риск наличия синдрома Дауна и не является показанием к консультации генетика и проведению других диагностических процедур. Необходимо контрольное УЗИ в 26-28 и 32 недели беременности для оценки темпов роста плода и оценки его функционального состояния.
6. Кисты сосудистых сплетений (КСС).
Сосудистые сплетения – одна из первых структур, которая появляется в головном мозге плода. Это сложная структура, и присутствие обоих сосудистых сплетений подтверждает, что в мозге развиваются обе половины. Сосудистое сплетение производит жидкость, питающую головной и спинной мозг. Иногда жидкость образует скопления внутри сосудистых сплетений, которые при УЗИ имеют вид “кисты”. Кисты сосудистых сплетений иногда могут быть найдены при ультразвуковом исследовании в сроках 18-22 недели беременности. Наличие кист не оказывает влияния на развитие и функцию головного мозга. Большинство кист самопроизвольно исчезает к 24-28 неделям беременности.
Часто ли встречаются кисты сосудистых сплетений?
В 1-2 % всех нормальных беременностей плоды имеет КСС, в 50 % случаев обнаруживаются двусторонние кисты сосудистых сплетений, в 90 % случаев кисты самопроизвольно исчезают к 26-ой неделе беременности, число, размер, и форма кист могут варьировать, кисты также найдены у здоровых детей и взрослых. Несколько чаще кисты сосудистых сплетений выявляются у плодов с хромосомными болезнями, в частности, с синдромом Эдвардса (трисомия 18, лишняя 18 хромосома). Однако, при данном заболевании у плода всегда будут обнаруживаться множественные пороки развития, поэтому выявление только кист сосудистого сплетения не повышает риск наличия трисомии 18 и не является показанием к проведению других диагностических процедур. При болезни Дауна кисты сосудистых сплетений, как правило, не выявляются. Риск синдрома Эдвардса при обнаружении КСС не зависит от размеров кист и их одностороннего или двустороннего расположения. Большинство кист рассасывается к 24-28 неделям, поэтому в 28 недель проводится контрольное УЗИ. Однако, если кисты сосудистых сплетений не исчезают к 28-30 неделям, это никак не влияет на дальнейшее развитие ребенка.
7. Расширение почечных лоханок (пиелоэктазия).
Почечные лоханки это полости, где собирается моча из почек. Из лоханок моча перемещается в мочеточники, по которым она поступает в мочевой пузырь.
Пиелоэктазия представляет собой расширение почечных лоханок. Пиелоэктазия в 3-5 раз чаще встречается у мальчиков, чем у девочек. Встречается как односторонняя, так и двухсторонняя пиелоэктазия. Легкие формы пиелоэктазии проходят чаще самостоятельно, а тяжелые иногда требуют хирургического лечения.
Причина расширения почечных лоханок у плода.
Если на пути естественного оттока мочи встречается препятствие, то моча будет накапливаться выше данного препятствия, что будет приводить к расширению лоханок почек. Пиелоэктазия у плода устанавливается при обычном ультразвуковом исследовании в 18-22 недели беременности.
Опасна ли пиелоэктазия?
Умеренное расширение почечных лоханок, как правило, не влияет на здоровье будущего ребенка. В большинстве случаев при беременности наблюдается самопроизвольное исчезновение умеренной пиелоэктазии. Выраженная пиелоэктазия (более 10 мм) свидетельствует о значительном затруднении оттока мочи из почки. Затруднение оттока мочи из почки может нарастать, вызывая сдавление, атрофию почечной ткани и снижение функции почки.
Кроме того, нарушение оттока мочи нередко сопровождается присоединением пиелонефрита – воспаления почки, ухудшающего ее состояние. Несколько чаще расширение лоханок почек выявляется у плодов с синдромом Дауна. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только расширения почечных лоханок не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур. Единственное, что нужно сделать до родов – пройти контрольное УЗИ в 32 недели и еще раз оценить размеры почечных лоханок.
Нужно ли обследовать ребенка после родов?
У многих детей умеренная пиелоэктазия исчезает самопроизвольно в результате дозревания органов мочевыделительной системы после рождения ребенка. При умеренной пиелоэктазии бывает достаточно проводить регулярные ультразвуковые исследования каждые три месяца после рождения ребенка. При присоединении мочевой инфекции может понадобиться применение антибиотиков. При увеличении степени пиелоэктазии необходимо более детальное урологическое обследование.
В случаях выраженной пиелоэктазии, если расширение лоханок прогрессирует, и происходит снижение функции почки, бывает показано хирургическое лечение. Хирургические операции позволяют устранить препятствие оттоку мочи. Часть оперативных вмешательств может с успехом выполняться эндоскопическими методами – без открытой операции, при помощи миниатюрных инструментов, вводимых через мочеиспускательный канал. В любом случае вопрос об оперативном лечении решается после рождения ребенка и полного его обследования.
Что делать при выявлении ультразвуковых маркеров хромосомной патологии у плода?
Вам следует обратиться к специалисту генетику, который еще раз оценит результаты ультразвукового исследования и биохимического скрининга, рассчитает риск индивидуально для вашего случая и даст необходимые рекомендации по дальнейшему ведению беременности.
© 2021 краевое государственное бюджетное учреждение здравоохранения “Красноярский краевой медико-генетический центр” (КГБУЗ “ККМГЦ”)
Ранняя диагностика синдрома Дауна: распространенные заблуждения и статистика
Еще в 1866 году Лэнгдон Даун заметил, что у пациентов с синдромом, которые получил название по фамилии ученого, маленький нос, плоское широкое лицо, толстая шейная складка. С возникновением ультразвука стали появляться более глубокие исследования в этой области, и диагностировать синдром Дауна стало возможным уже у эмбрионов. Главный врач Клиники МАМА Виктория Викторовна ЗАЛЕТОВА рассказывает об истории этих исследований и новейших достижениях.
Врачи всего мира работают в условиях определенной догматики: стопроцентной методики дородовой диагностики синдрома Дауна на данный момент не существует. Фактор риска присутствует всегда. И усилия специалистов разных областей во многих странах направлены на то, чтобы сделать его минимальным.
Одним из важнейших критериев — или ультразвуковых маркеров — при диагностировании синдрома Дауна у эмбрионов является толщина воротникового пространства (ТВП). У любого плода на сроке 11-14 недель можно ее измерить. Было замечено, что у 75% эмбрионов с синдромом Дауна ТВП больше, чем у обычных плодов. Позже были открыты не менее важные ультразвуковые маркеры: длина носовых костей, оценка кровотока в венозном протоке и на трикуспидальном клапане.
Риск, что у ребенка будут присутствовать какие-либо хромосомные аномалии, есть всегда. По синдрому Дауна он составляет порядка 1 на 500. Чем старше мама, тем больше риск (риск резко возрастает после 35 лет).
Доктор Николаидес, основатель Фонда Медицины Плода, и его коллеги в Лондоне в первом триместре беременности выявляют до 95% плодов с синдромом Дауна. Но есть так называемые «нечувствительные дауны» — они «нечувствительны» к этой диагностике. Их количество по данным Фонда Медицины Плода порядка 5%. Это те эмбрионы, которые пройдя биохимический и ультразвуковой скрининг показали абсолютно нормальные значения.
В последние годы пренатальная диагностика хромосомных патологий плода совершенствуется. Был разработан метод ДНК секвенирования клеток плода из крови матери. На 9-ой—10-ой неделе беременности пациентка сдает кровь, из которой «вылавливаются» клеточки эмбриона. И эти клетки анализируются на присутствие основных хромосомных патологий. Данный метод тоже имеет погрешность и не может поставить окончательный диагноз. Но ДНК секвенирование позволяет определить необходимость инвазивной диагностики.

Проведение преимплантационной генетической диагностики эмбрионов (ПГД) в рамках программ ЭКО так же является высокотехнологичной методикой выявления основных хромосомных аномалий, в том числе синдрома Дауна. Исследование позволяет заподозрить проблему на самом раннем этапе и не переносить в полость матки эмбрионы с заведомо лишней хромосомой. Но ПГД как и ДНК-секвенирование имеет свой процент ложно-положительных и ложно-отрицательных результатов. Поэтому в последствии для исключения риска хромосомных патологий требуется проведение комбинированного скрининга с дальнейшей инвазивной диагностикой. Инвазивная методика несет определенные риски по потере беременности, но только это исследование дает более точные результаты.
Комбинированный скрининг в первом триместре позволяет заподозрить патологию плода. Это вспомогательный метод, целью которого является выявление группы риска на основе ультразвуковых и биохимических маркеров. У 75% плодов с синдромом Дауна может быть расширено воротниковое пространство, у 25% оно будет нормальное. У 35-40% плодов с хромосомной патологией наблюдается аномальный венозный кровоток — у остальных он будет нормальный. Поэтому нужна комплексная оценка. Чем больше маркеров рассматривается, тем больше вероятность правильного заключения по этому эмбриону. По-прежнему во всем мире идет поиск новых маркеров. Все врачи пренатальной ультразвуковой диагностики очень этим озабочены, каждый год появляются новые исследования на эту тему.
На основе первого скрининга формируется группа риска. Но это еще не означает наличие синдрома Дауна у эмбриона, речь о подозрении. При расчете индивидуального риска отнесение к группе с высокой вероятностью присутствия заболевания в том числе может произойти из-за возрастного фактора, могли сказаться сывороточные маркеры, отражающие гормональный фон. Что касается расширения воротникового пространства, помимо синдрома Дауна, порядка 50-ти патологий сопровождаются этим признаком.
Практика такова: ложно-положительные и ложно-отрицательные результаты присущи любому скрининговому исследованию. Стопроцентная точность невозможна, это вспомогательный метод для выявления группы риска. Последующие исследования — консультация генетика, инвазивные методики и консилиум врачей разных специальностей — дают возможность подтвердить или опровергнуть диагноз.
У специалистов в этой области существует профессиональное определение «российские плоды с синдромом Дауна очень сложны для диагностики». В отличие от европейских плодов с синдромом Дауна они очень часто попадают в окно нормальных значений толщины воротникового пространства, длины носовой кости и пр. Их сложно выявить. Дело в том, что на территории нашей страны смешалось много наций. В наших жилах течет очень разная кровь, велико присутствие генов монголоидной расы. А при анализе ультразвуковой картины учитываются национальные особенности. И зачастую отклонение от нормативных значений можно принять за этнические черты.
Статистически в популяции на 100 000 плодов только 200 будут иметь синдром Дауна. При этом еще 200 будут иметь другие хромосомные дефекты и 99 600 будут иметь нормальный набор хромосом. Таким образом у порядка 5% эмбрионов воротниковое пространство, как ключевой показатель, будет выше нормативных значений.
Акушер-гинеколог, ведущий беременность, основываясь только на данных ультразвукового исследования и на уровне биохимических маркеров, не может судить, есть ли у плода синдром Дауна. После комбинированного скрининга пациентка направляется в медико-генетический центр. Для подтверждения или опровержения диагноза потребуется консультация врача-генетика и инвазивная пренатальная диагностика.
Врач-генетик анализирует уровень сывороточных маркеров, собирает анамнез, анализирует ультразвуковое исследование и, возможно, назначает повторный ультразвук у врача экспертного уровня. Если высокий риск присутствия хромосомной патологии подтверждается, следующий этап — это инвазивная пренатальная диагностика. В зависимости от срока беременности выделяют хорионбиопсию (на сроке от 11 до 15 недель) и амниоцентез.
Хорион — это будущая плацента, для анализа берут ее образец, в этом материале выявляют клетки плода и исследуют их ДНК. Амниоцентез выполняется после 15 недель — для анализа берется амниотическая жидкость (жидкость, в которой находится плод), в ней также выделяются клетки плода.
Инвазивное исследование назначается только при выявлении высокого риска по результатам комбинированного скрининга — 1:100 и выше (1:50, 1:20). Дело в том, что у каждой инвазивной методики есть процент потерь беременности. Он приблизительно равен 1%. То есть после проведения процедуры одна из ста пациенток может потерять беременность. Поэтому проведение инвазивного исследования должно быть оправдано высокими рисками появления ребенка с хромосомными аномалиями.
Инвазивные методы исследование дают порядка 90-99% точности в определении хромосомной патологии плода. Проводить или не проводить инвазивный тест, оставлять или прерывать беременность после подтверждения подозрений — окончательное решение остается за будущими родителями. Им предстоит оценить все риски, возможные последствия и принять итоговое решение. Долг врача — предоставить пациентке максимально полную информацию, дать предполагаемый прогноз. Но решение судьбы беременности и ответственность за будущее ребенка все-таки лежит на его родителях.
В 21 веке планирование и рождение детей происходит в принципиально изменившихся реалиях. Новые возможности медицины по диагностике, ухудшение экологической ситуации, повышение возраста первой беременности. Все эти факторы значительно меняют сам подход к рождению детей. Сегодня вынашивание ребенка требует от женщины достаточно высокой компетентности в медицинских, социальных и даже правовых вопросах. Все большее значение приобретает подготовка к зачатию. Поэтому мировая медицина однозначна в своих рекомендациях: планирование любой беременности стоит начинать с консультации репродуктолога. Обращаясь в Клинику МАМА, вы можете быть уверены, что получите полный цикл диагностических и лечебных услуг европейского уровня.
Прогностическое значение толщины воротникового пространства в пренатальной диагностике врожденной патологии плода
Челябинская государственная медицинская академия
Проблема наследственной и врожденной патологии, прежде всего врожденных пороков развития (ВПР), хромосомных и моногенных заболеваний за последнее десятилетие приобрела серьезную социально-медицинскую значимость. Частота врожденной и наследственной патологии в популяции составляет в среднем 5% от числа новорожденных детей. В структуре перинатальной заболеваемости и смертности врожденная и наследственная патология занимает 2-3 место. Широкое внедрение в клиническую практику скринингового ультразвукового исследования в 11-14 недель беременности позволяет провести раннюю пренатальную диагностику ВПР и хромосомных аномалий (ХА) [4]. Среди многочисленных эхографических маркеров ХА наиболее ценным считается толщина воротникового пространства [5]. Использование этого маркера позволяет выявлять до 66,7-92% хромосомных дефектов уже в ранние сроки беременности [6, 7]. Поэтому представляет научный интерес дальшейшее изучение увеличения толщины воротникового пространства (ТВП) плода как пренатального эхографического маркера врожденной и наследственной патологии.
Целью исследования явилась оценка величины толщины воротникового пространства плода в качестве маркера хромосомных аномалий и врожденных пороков развития плода.
Материал и методы. Тип исследования: когортное с проспективной когортой (2008 – 2010 г.).
Метод выборки: сплошной по мере обращения.
1. Беременность в сроке гестации 11–14 недель.
2. Известная дата последней менструации при 26–30 дневном цикле.
3. Согласие женщины на участие в исследовании.
1. Нарушения менструального цикла.
2. Указание на прием гормональных контрацептивов за два месяца до цикла зачатия.
3. Стимулированная беременность.
4. Многоплодная беременность.
В соответствии с критериями включения/исключения за указанный период было отобрано 1310 беременных в сроки гестации от 11 до 14 недель, состоявших на диспансерном учете в женских консультациях г. Челябинска.
После проведения ультразвукового скрининга беременные были распределены на две группы, с учетом размеров толщины воротникового пространства (ТВП) плода: основная группа – 175 женщин с увеличением размеров толщины воротникового пространства у плода (группа 1), группа сравнения – 1135 пациенток с нормальными размерами толщины воротникового пространства у плода, беременность которых завершилась своевременными родами и рождением нормальных здоровых детей (группа 2). В качестве пороговых (разделительных) значений принимался 95‰ ТВП от показателей, разработанных в результате наших исследований, согласно рекомендациям Н.А. Алтынник и М.В. Медведева и К. Николаидеса и соавт. [1,7]. Группы были сопоставимы по возрасту, паритету и сроку гестации.
Эхографические исследования проведены на ультразвуковых сканерах фирмы TOSHIBA (Япония) высокого (XARIO XG) и экспертного (APLIO XG) классов. Для измерения размеров ТВП использовали трансабдоминальный доступ сканирования. В случаях регистрации у плода эхографических маркеров хромосомных дефектов или врожденных пороков развития, исследование завершали трансвагинальным доступом для детального изучения анатомии и проведения расширенной эхокардиографии плода. В ходе пренатального консультирования пациентке сообщали о наличии риска хромосомной патологии и объясняли целесообразность пренатального кариотипирования. В сроке 11-13 недель гестации осуществляли трансабдоминальную аспирацию ворсин хориона. При отказе от пренатального кариотипирования в ранние сроки и выявлении других эхографических маркеров хромосомной патологии или врожденных пороков развития плода во втором триместре беременности, рекомендовалась оценка кариотипа плода методом кордоцентеза в 21-24 недели.
Статистический анализ данных проводился при помощи пакета статистических программ STATISTICA 6.0 (StatSoft, 2001) и программы MedCalc (9.1.0.1) for Windows. При распределении признака в выборке, близком к нормальному, количественные значения представлялись в виде средней арифметической и ее среднеквадратичного отклонения (M±σ).
Для оценки различий между двумя группами в количественных признаках с учетом характера распределения, близкому к нормальному, применяли t-критерий Стьюдента. Оценка межгрупповых различий по качественным признакам проводилась с использованием критерия χ 2 , а при ожидаемых частотах менее 10 – применялась поправка Йетса.
С целью оценки прогностической значимости показателей проводился ROC-анализ с вычислением чувствительности, специфичности, отношения положительного и отрицательного правдоподобия. Для всех видов анализа статистически достоверными считались значения p 0,05).
Согласно полученных нами данным толщина воротникового пространства плода в группе 2 (со своевременными родами и рождением здорового ребенка) постепенно увеличивается на сроках от 11 до 14 недель, составляя в среднем 1,3±0,3 мм в 11–12 недель, 1,4±0,4 мм в 12–13 недель и 1,5±0,3 мм в 13-14 недель, при отсутствии различий между величинами ТВП в эти сроки беременности (р>0,05).
В табл. 1 представлены значения толщины воротникового пространства плода в 11–14 недель беременности в группах сравнения.
Таблица 1. Показатели толщины воротникового пространства плода в 11–14 недель беременности в группах сравнения
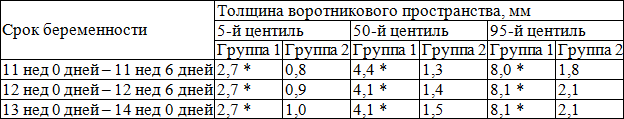
Примечание: * – значимость различий (р 0,05
Таким образом, в соответствии с полученными данными, необходимо выделять пациенток с расширением ТВП у плода в группу высокого риска по врожденным порокам развития даже при отсутствии хромосомной патологии. Особое внимание следует уделять детальному изучению анатомии плода и эхокардиографическому исследованию, так как множественные врожденные пороки развития и пороки сердца регистрируются наиболее часто.
С целью оценки прогностического значения величины ТВП в отношении развития хромосомных аномалий плода в группах сравнения нами использовался ROC-анализ (рис. 4).
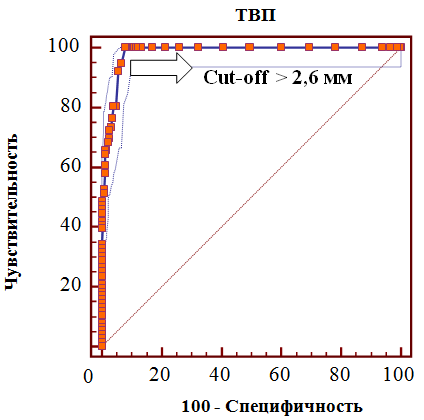
Рис. 4. ROC-кривая прогностического значения толщины воротникового пространства в отношении хромосомных аномалий плода
Проведенный анализ показал, что толщина воротникового пространства выше 2,6 мм ассоциирована с высоким риском развития хромосомных аномалий, причем указанный уровень имеет высокую чувствительность (100%) и специфичность (89,7%), а также отношение правдоподобия положительного результата (9,65), р
Список использованных источников:
1. Нормативные значения копчико-теменного размера и толщины воротникового пространства плода в ранние сроки беременности/ Н.А. Алтынник, М.В. Медведев// Ультразвуковая диагностика. Акуш. Гин. Педиат. – 2001. – Т. 9, №1. – С. 38–40.
2. Диагностическая ценность расширенного воротникового пространства в сочетании с допплеровским исследованием плодово-плацентарного кровотока в I триместре беременности при врожденной и наследственной патологии/ С.Г. Ионова, И.П. Цымбалова, А.В. Сидорова// Пренатальная диагностика. – 2004. – Т. 3, №3. – С. 233.
3. Копытова Е.И. Расширенное воротниковое пространство плода как пренатальный эхографический маркер врожденных и наследственных заболеваний: Автореф. дис. … канд. мед. наук. – М., 2007. – 22 с.
4. Медведев М.В. Основы ультразвукового исследования в акушерстве. – М.: Реал Тайм, 2006. – 96 с.
5. Основы ультразвукового скрининга в 11-14 недель беременности/ М.В. Медведев, Н.А. Алтынник. – М.: Реал Тайм, 2008. – 88 с.
6. Новый подход к расчету риска при проведении скринингового ультразвукового исследования в первом триместре беременности/ Е.С. Некрасова, А.Л. Коротеев, Т.В. Кузнецова, В.С. Баранов// Пренатальная диагностика. – 2005. – Т. 4, №1. – С. 22–28.